海恩斯坦医用口罩测试要求及方法说明
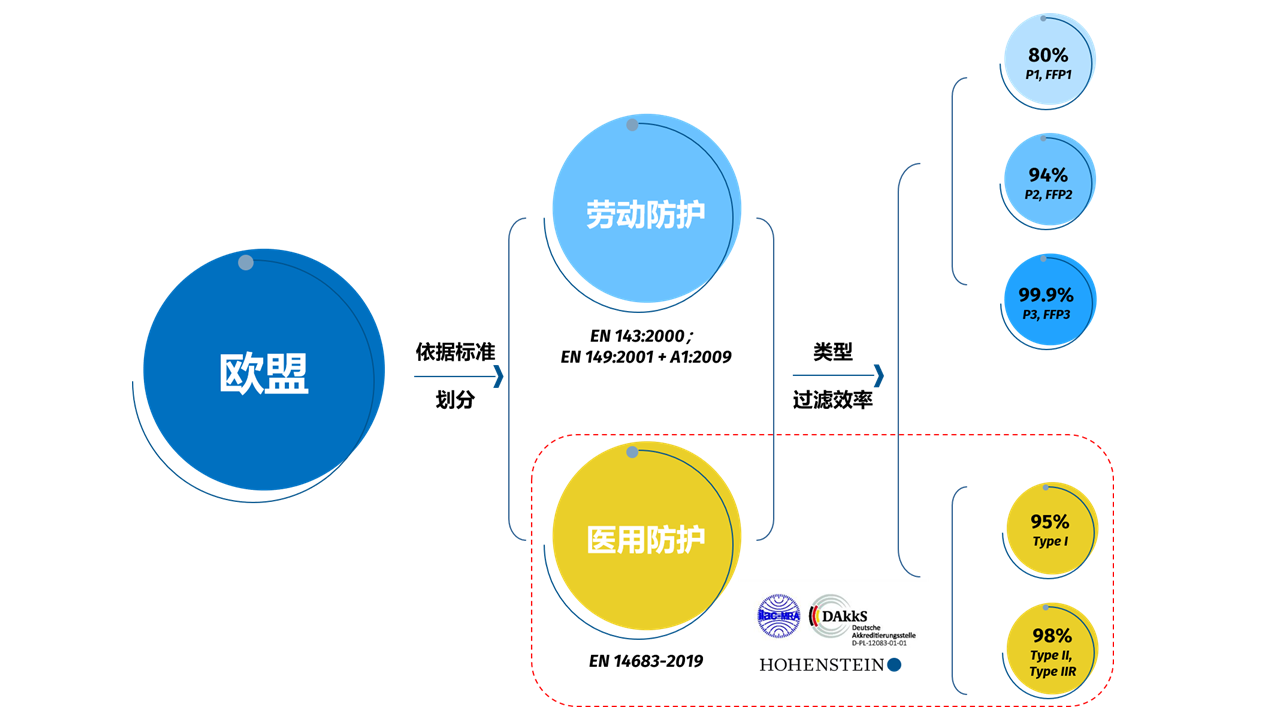
在欧洲,口罩根据欧盟标准划分为“劳动防护”和“医用防护”两种。其中,医用外科口罩属于Ⅰ类医疗器械产品,并受医疗器械法规(Medical Device Regulation,MDR)EU 2017/745的管辖。
海恩斯坦实验室的检测能力经由DAkkS认证,拥有医用口罩/医用外科口罩的测试资质,我们的测试报告可与您的技术文件和临床评估报告一同作为申报的资料。 需注意:若要完全获准成为医疗产品还需进一步的测试和资料证明。(受新冠肺炎疫情影响,各国可能根据当下国情调整相应的审核要求。)
欧洲“医用防护”标准EN 14683中规定,医用口罩根据细菌过滤效率分为I类和II类, II类则根据口罩的是否防飞溅而进一步划分,带有“R”的口罩表示防飞溅。

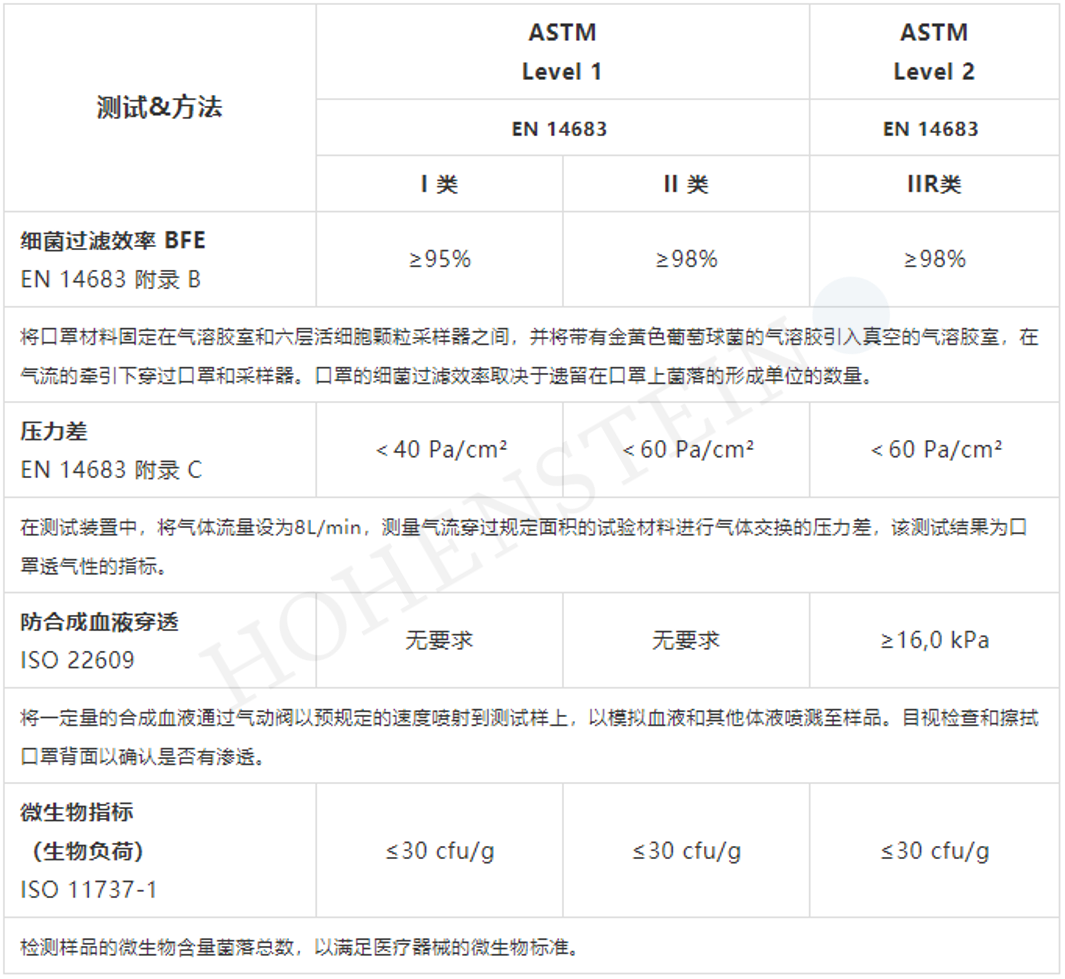
需注意:I 类医用口罩的主要用途是保护患者免受感染源的侵害,可以防止佩戴者遭液体(飞沫、血液、体液)飞溅被感染。尤其在疫情或流行病肆虐的情况下,患者及健康人群均可佩带医用口罩,以减少病菌传播的风险。但该类型不适用于手术室或医疗场所的医疗防护人员。
此外,海恩斯坦还可以根据细胞毒性DIN EN ISO 10993-5标准提供医疗器械的生物相容性测试 ,在细胞培养测试中,皮肤细胞用于检测样品中所释放的细胞破坏性物质(如细胞毒素)。因此,该测试可以评估产品与皮肤接触时对细胞造成损害的潜在风险。 基于细胞毒性ISO 10993-5测试的产品,其提取物用L929皮肤细胞培养数天,与未经处理的对照培养物对比,如果细胞活性降低超过30%,则产品被评估为具有明显的细胞毒性,反之,则为“生物安全”。通过测试的产品将被授予“生物安全”证书。
模板展示:

测试样品要求:
样品数量:
I类/II类:50个样品
IIR类:130个样品
测试时长:
· 提交样品进行以上全部测试约3周
· EN 14683附录C(压力差)和ISO 10993-5(细胞毒性)约1周
· EN 14683附录B(细菌过滤效率)和ISO 11737-1(微生物指标)约2周
· ISO 22609(防合成血液穿透)约3周
医用口罩:
医用或外科口罩的主要作用为减少佩戴者口腔/鼻部的唾液或粘液进入外界环境中。由于该类型口罩无法紧密贴合面部,因此针对空气传播感染能提供的防护有限。但是佩戴口罩可以避免被污染的手与口鼻接触。医用口罩必须符合EN 14683标准。

呼吸防护口罩:
颗粒过滤口罩 (FFP) 可防止固体或液体的气溶胶传播。作为典型的个人防护用品,必须符合PPE(EU)2016/425法规要求 。颗粒过滤型口罩(半面罩)必须满足DIN EN 149的规定。该标准根据微粒滤波器的过滤能力将口罩划分为FFP1、FFP2 和 FFP3三个级别。紧密贴合的 FFP2 口罩可针对传染性气溶胶(包括病毒)提供适当的防护。